Effekt inntil 52 uker ved Crohns sykdom
Studiedesign GEMINI II1,2
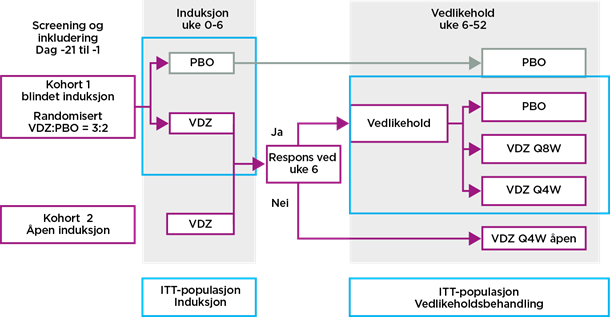
Induksjonsbehandling
I Gemini II ble pasienter randomisert til å få blindet induksjonsbehandling med Entyvio® eller placebo. En gruppe fikk også åpen behandling med Entyvio®.
Vedlikeholdsbehandling
Pasienter både fra åpen og blindet induksjonsbehandling, med respons i uke 6, ble randomisert til blindet vedlikeholdsbehandling med Entyvio® hver åttende eller hver fjerde uke, eller placebo. De som ikke oppnådde respons ved uke 6 fikk vedlikeholdsbehandling med Entyvio® åpent hver fjerde uke.
Pasienter med Crohns sykdom i GEMINI II1,2
I Gemini II (n = 1115) ble effekt og sikkerhet av Entyvio® undersøkt ved behandling av pasienter med moderat til alvorlig aktiv Crohns sykdom.
Pasienter sviktet på minst én behandling
Pasienter i Gemini II hadde hatt minst én sviktende konvensjonell behandling (for eksempel kortikosteroider og/eller immunmodulatorer) og/eller TNFα-hemmer for Crohns sykdom.

Induksjonsbehandling GEMINI II
I GEMINI II ble 368 pasienter randomisert til å få blindet behandling med Entyvio® (n = 220) eller placebo (n = 148). Dessuten fikk 747 pasienter åpen behandling med Entyvio®.
Vedlikeholdsbehandling GEMINI II
Pasienter med klinisk respons på Entyvio® (n = 461) i uke 6 ble videre randomisert til blindet vedlikeholdsbehandling med enten Entyvio® hver åttende eller hver fjerde uke, eller til placebo.
Dosering i studien og kombinasjon med andre legemidler
Pasientene ble behandlet med placebo eller 300 mg Entyvio® hver 4. eller 8. uke. Samtidige stabile doser av orale kortikosteroider, immunomodulatorer og antibiotika var tillatt i alle grupper.
For mer informasjon, se www.felleskatalogen.no.
Effektdata uke 6 og 52 (GEMINI II)1,2
I Gemini II (n = 1115) ble effekt og sikkerhet av Entyvio® undersøkt ved behandling av pasienter med moderat til alvorlig aktiv Crohns sykdom. Primære endepunkter i uke 6 var andel pasienter med klinisk remisjon (CDAI ≤ 150) samt andel pasienter med økt klinisk respons (CDAI-100 respons).
Primært endepunkt i uke 52 var klinisk remisjon.
Resultatene viste signifikant forskjell i klinisk remisjon, men ikke i CDAI-100 respons mellom Entyvio® og placebo i uke 6.


Signifikant flere pasienter oppnådde klinisk remisjon etter ett år med Entyvio®, sammenlignet med placebo.
- Steroidfri remisjon i uke 52
Dobbelt så mange av pasientene som sto på steroider ved studiestart og fikk Entyvio® (32 %) oppnådde steroidfri remisjon i uke 52 sammenlignet med placebo (16 %). (p = 0,02)
For mer informasjon, se felleskatalogtekst Entyvio®, link til www.felleskatalogen.no
Definisjoner
- Klinisk remisjon: CDAI-score ≤ 150 poeng
- Økt klinisk respons: En reduksjon med ≥ 100 CDAI-score sammenlignet med utgangspunkt (baseline)
- Steroidfri remisjon: Pasienter som brukte perorale kortikosteroider ved utgangspunkt (baseline) og som hadde kortikosteroidnedtrapping fra uke 6 og var i klinisk remisjon uten steroider i uke 52.
Referanser
- Sandborn WJ, Feagan BG, Rutgeerts P et al. Vedolizumab as induction and maintenance therapy for Crohn’s disease. The New England Journal of Medicine. 2013;369(8):711–21.
- Entyvio® SPC (sist godkjent 20.02.2019), avsnitt 5.1. www.legemiddelsok.no